2025 版《中国药典》10 月实施,苏州益康环境纯化水检测资质获更新,筑牢行业合规防线

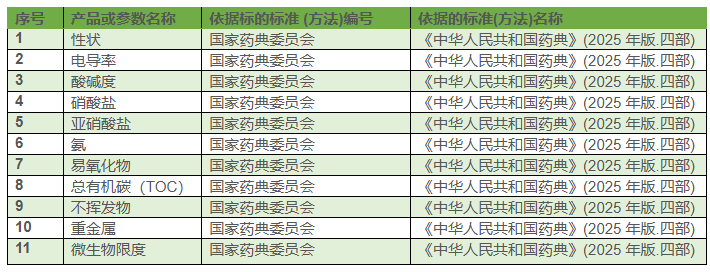
2025 年版《中国药典》在 2020 年版基础上实现了标准体系重构、技术要求升级、监管逻辑优化,覆盖品种收载、检测方法、限度标准等核心维度的系统性革新。以下从 8 个关键领域展开细化对比,结合具体品种案例与技术细节说明差异:
2025 版收载品种总计6385 种,较 2020 版(6182 种)净增 203 种,核心变化体现在 “新增临床急需品种、淘汰风险品种、优化分类逻辑" 三大方向:
类别 | 2020 年版情况 | 2025 年版核心变化 |
中药(一部) | 收载 2711 种,以传统品种为主 | 增至 3069 种,新增 28 种(如临床急需的慢性病用药),不再收载 19 种:・淘汰野生濒危原料品种(如含穿山甲的制剂)・剔除安全性存疑品种(如妇科通经丸、胡蜂酒)・新增三七净制饮片(允许临方打粉,避免灭菌导致皂苷流失 35% 以上) |
化学药(二部) | 收载 2714 种,仿制药标准占比高 | 增至 2776 种,新增 66 种:・自主研发抗癌药(注射用、洛铂)・心血管药物(坎地沙坦酯氢氯噻嗪片 Ⅰ/Ⅱ)・收载 5 个生物类似药(利妥昔单抗等)・纯化水、注射用水转至四部收载 |
生物制品(三部) | 收载 153 种,疫苗类占比不足 30% | 新增 13 种,修订 62 种:・创新疫苗(双价 HPV 疫苗、13 价肺炎球菌多糖结合疫苗)・单抗药物(曲妥珠单抗、贝伐珠单抗)・淘汰 13 种工艺落后品种(如传统血液制品) |
药用辅料(四部) | 收载 335 种,与制剂关联性弱 | 增至 387 种,新增 52 种(如新型包衣材料),修订 136 种,强化与制剂安全性的关联(如注射用氯化钠内毒素限值收紧) |
2025 版全面淘汰非专属性方法,推广高灵敏度技术,新增69 项通用技术要求,检测体系与国际药典(USP/EP)的一致性提升至 85% 以上:
• 农残检测:新增 9 种农药(嘧霉胺、百菌清、多效唑等),采用 LC-MS/MS 强制确认,禁用农药由 33 种扩至 47 种,新增杀扑磷、氧乐果等 14 种高毒种。
• 重金属检测:
◦ 统一 52 种中药材(铅≤5mg/kg、镉≤1mg/kg、汞≤0.1mg/kg),汞限值较 2020 版收紧 50%;
◦ 新增原子荧光光谱法(AFS),简化汞元素检测流程(贮备液浓度从 0.5μg/mL 提至 1μg/mL,提升稳定性)。
• 真伪鉴别:强制龟甲胶、鹿角胶等采用 DNA 条形码鉴定,丹参酮提取物新增 “特征峰相对保留时间偏差≤±5%" 要求。
• 方法替代:全面淘汰非专属性滴定法(如部分抗生素的酸碱滴定),推广 HPLC/UPLC,如阿莫西林胶囊含量测定由滴定法改为 HPLC,定量限提升至 0.05%。
• 杂质检测:
◦ 基因毒性杂质(如硝基苯类)需按 ICH M7 指南验证,采用 LC-MS/MS 检测,检出限≤0.01ppm;
◦ 注射剂新增亚硝胺类杂质筛查,参考 FDA/EMA 标准。
• 溶出度:新增往复筒法(第三法),模拟肠道动态溶出,如非诺贝特缓释片需同步测试 pH 1.2、4.5、6.8 介质中的释放度。
• 宿主细胞残留:单抗药物(如利妥昔单抗)强制采用 qPCR 法检测 CHO 细胞 DNA 残留,限值≤10pg/mg,较 2020 版(ELISA 法,≤100pg/mg)灵敏度提升 10 倍。
• 纯度分析:ADC 药物新增 “抗体偶联位点" 检测,采用 LC-MS/MS 确认偶联效率,避免无效偶联物导致毒性风险。
2025 版基于风险评估,对高风险品种、关键杂质、生产过程指标设定更严格限值,倒逼产业升级:
类别 | 2020 年版标准 | 2025 年版标准 | 涉及品种举例 |
注射剂可见异物 | ≥10μm 粒子≤500 个 / 瓶 | ≥10μm 粒子≤300 个 / 瓶 | 维生素 C 注射液、氯化钠注射液 |
中药汞含量 | ≤0.2mg/kg | ≤0.1mg/kg | 人参、当归、甘草等 52 种药材 |
化学药残留溶剂 | 非特定溶剂总量≤0.5% | 非特定溶剂总量≤0.3% | 口服固体制剂(如阿司匹林片) |
生物制品宿主蛋白残留 | ELISA 法,≤100ng/mg | LC-MS/MS 法,≤10ng/mg | 贝伐珠单抗、曲妥珠单抗 |
中药浸出物 | 川贝母≥9.0% | 川贝母≥7.0%(删除含量测定项) | 川贝母饮片 |
原料药晶型 | 无强制要求 | 特定晶型比例≥95% | 多晶型他汀类药物 |
◦
上一篇 : 校准无尘室气流流形检测仪的主要步骤
下一篇 : 生物安全柜检测项目与技术要求